浏览量: 2020
- 产品名称: 2 × Ezmax-Single CloneMix Plus
- 产品货号: 24309
- 货期: 现货
- 价格与订购: 800/1300/4550
- 数量:
库存: 100
- 规格: 25rxn 50rxn 250rxn
- 产品信息
- 如何订购
1、产品简介
Ezmax®“一步法快速克隆试剂盒”可用于无缝克隆外源 DNA 片段:简单、快速、 高效。该方法不依赖于任何限制性内切酶,可将任何外源 DNA 片段定向克隆至任意载体的任意位 点(特殊情况,如有毒基因的克隆或插入外源 DNA 后导致质粒本身不稳定等除外)。因此,在基因克隆、DNA 拼接和 DNA 定点突变等领域有广泛用途。
2、产品组成
| 组分 | 24309-01 (25rxn) |
24309-02 (50rxn) |
24309-03 (250rxn) |
| 2×Ezmax-Single CloneMixPlus | 250μL | 500μL | 5×24309-02 |
| Control(1:1):4-kb vector+2.2-kb insert (50ng/μL) |
5μL | 5μL |
注:阳性对照载体为 Amp 抗性。
3、产品保存
本产品应置于-20 °C 储存,并在使用时注意保持低温(如置于冰上)。
4、使用说明
4.1 制备线性化载体
在靶标载体上选择合适的克隆位点,对克隆载体进行线性化处理。如果可以选择的话,建议尽量 选择无重复序列、无高级结构且 GC 含量在 40%~65%之间的区域用于外源 DNA 的克隆。常用的载 体线性化方法包括:限制性内切酶酶切和设计反向引物进行 PCR 扩增制备。
4.2 酶切法制备线性化克隆载体
如果有合适的酶切位点,建议使用该方法,整个操作流程也比较简单。其中,双酶切比单酶切更 好。酶切后,可以取少量酶切产物进行电泳,以确保全部载体被切开。对于绝大部分酶,可以对 酶切产物进行 65° C 高温 20 min 灭活,然后直接用于后续无缝拼接反应,而无需对酶切的载体进行 胶回收或过柱回收等处理。

4.3 设计反向引物进行 PCR 扩增制备
建议使用高保真 DNA 聚合酶进行载体的扩增(如 FastPfu 酶等)以降低 PCR 扩 增过程中引入的突变率。本试剂盒与常规 PCR 的反应体系兼容;因此,如果 PCR 产物条带单一, 则可直接用于后续的重组反应(注:线性化载体作为模板时无需去除;而环形载体需要去除。如 载体有甲基化,则可使用 DpnI 进行酶切去除)。反之,如果 PCR 扩增产物的纯度较低,则应将 PCR 产物进行电泳后用胶回收进行纯化。

4.4 设计用于扩增外源 DNA 片段的引物
通过在引物的 5’端引入与线性化克隆载体末端一致的 DNA 序列,长度在 15-20 bp 之间。以克隆外 源 DNA 到公司的 pUC18H 质粒的 HincII 位点为例,扩增引物的设计如下图 1 所示:
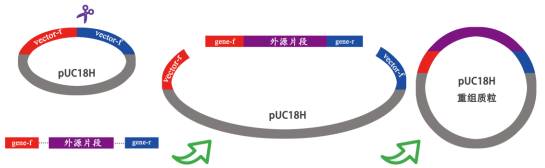
图 1. 使用一步法克隆试剂盒时引物设计原理。
注意外源 DNA的正/反向引物(gene-f/ gene-r)携带 20 bp 序列,与载体的末端序列同源(反向 互补)。pUC18H 为公司在通用质粒 pUC18 的基础上改造获得的,可以用于目的基因的克 隆。pUC18H 被去除了绝大部分常用的酶切位点,且可用蓝白斑进行筛选。
建议使用高保真 DNA 聚合酶(如 FastPfu 酶等)进行外源 DNA 片段的扩增; 无需考虑产物末端是否有 A加尾,不影响最终的拼接(即使加了 A,也会在后续的拼接反应中被切 除)。与载体制备的流程类似,如果外源 DNA 的 PCR 扩增条带比较特异,则可以不用纯化,直接 用于后续的拼接反应(注:如果用于制备外源 DNA 的模板为环形质粒,且抗性和后续拼接的载体 相同,则残留的外源模板会造成转化背景,因而需要去除。可以通过胶回收或者 DpnI 酶切去除含 有甲基化修饰的模板)。
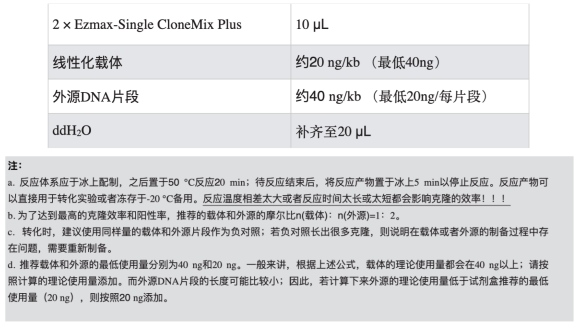
4.5 进行重组反应
4.6 反应产物转化
上述反应液可以直接用于感受态转化(一般为大肠杆菌感受态;推荐使用高效率感受态细胞)。热激法转化流程:将反应液加到 100-200 μL感受态细胞中,混匀后于冰上放 置 30 min;42 °C 热激 90 秒,冰水浴孵育 2 min;加入 800 μL SOC 或 LB 培养基,于 37 °C 摇床孵 育 45 min。取适量(10-100 μL)菌液均匀涂布在含有适当抗生素的平板上。将平板倒置于 37 °C 培 养箱过夜培养。 平板上长出的克隆可以使用“菌落 PCR 的方法”进行快速鉴定(或者“质粒快速抽提 的方法”)。针对阳性克隆,可根据实验需求 进行进一步的序列测定。
注:
a.除了大肠杆菌感受态细胞外,反应产物理论上也可以直接转化其它物种的化学感受态细胞。
b.由于反应体系中含有盐离子,反应产物不可以直接用于电击转化;若需要电击转化,则需要对反应产物进行脱盐处理。由于用于反应的DNA很少,不推荐使用乙醇沉淀或者胶回收纯化,可使用适合微量DNA透析的滤膜进行脱盐处理。
5、阳性对照
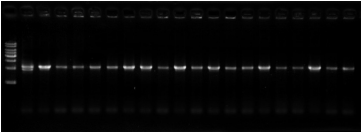
图 2. 使用试剂盒的阳性对照进行无缝拼接的实验结果。最左边泳道为 1-kb DNA ladder。
使用阳性对照,载体(4 kb)和 1 个外源 DNA 片段(2.2 kb)进行无缝拼接,长出的克隆利用菌落 PCR 的方法进行验证,正确的目的条带大小应该为 2.2 kb 左右。从图 2 中可以看出,随机挑选的 20 个克隆全部正确(100%阳性率)。随后对上述阳性克隆进行两端 DNA 测序;测序结果表明,阳性 克隆的序列全部正确。
6、常见问题

Note
For research use only. Not suitable for clinical or therapeutic use.

 地 址:
地 址: 产品销售:
产品销售: E - mail :
E - mail : 邮 编:
邮 编:
 Amily
Amily


