
浏览量: 2968
- 产品名称: 2 × Ezmax ® Universal CloneMix
- 产品货号: 24305
- 货期: 现货
- 价格与订购: 1580
- 数量:
库存: 100
- 规格: 50rxn
- 产品信息
- 如何订购
产品简介
2 × Ezmax ® Universal CloneMix 是基于同源重组原理开发的一步法单片段/多片段通用型无缝克隆试剂盒,Ezmax ®系列重组克隆试剂盒属于非连接酶依赖型体系,载体自连背景极低。高度优化的2 ×Ezmax®Universal CloneMix 预混了增强型重组酶和重组反应所需缓冲液,可显著提高克隆的重组效率及对杂质的耐受程度,因此制备的高纯度线性化载体和插入片段可不纯化直接用于重组克隆,大大简化了实验操作。本试剂盒可以将含有载体末端重叠区域的插入片段定向重组至任何载体的任何位点,不受酶切位点限制(特殊情况,如有毒基因的克隆或插入外源 DNA 后导致质粒本身不稳定等除外),可以插入单个片段,也可以一次插入多至 5 个顺序拼接的片段,载体末端与插入片段末端以及相邻插入片段末端之间需要15-25bp 能够相互同源重组的完全一致的序列。插入片段和线性化载体在重组酶作用下,仅需37℃反应5-30min即可完成重组,重组产物不依赖连接酶直接转化至感受态细胞,所获得的阳性克隆率在95%以上。
产品组成
| 组分 | 24305-01(50rxns) |
| 2×Ezmax® Universal CloneMix | 500μL |
| Control(Linearized plasmid+Insert fragment,Ampr)a | 40μL |
a.阳性对照 Control 中包含了 4.6 kb 的线性化载体和 1 kb 的插入片段,Amp 抗性。使用时直接取 10 μL Control 加入10 μL 2×Ezmax®Universal CloneMix,,即组成 20μL 重组反应体系。
保存条件
-20℃储存,≤ 0℃运输。
产品特点
◇ 快速:可在 5-30 min 内完成重组;
◇ 高通量克隆:不受酶切位点限制,无需对片段酶切;
◇ 无缝克隆:不引入额外序列。
适用范围
适用于 1~5 个片段的快速无缝克隆、定点突变和高通量克隆等实验。
原理示意图
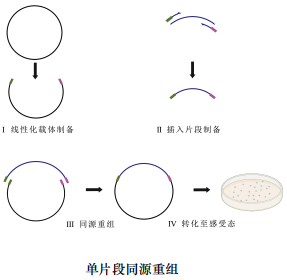
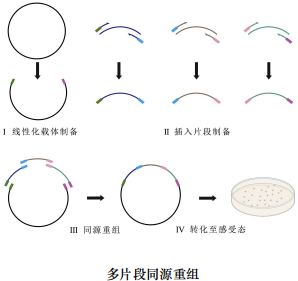
实验流程
操作示例
1. 制备线性化载体
在目标载体上选择合适的克隆位点,对克隆载体进行线性化处理。建议尽量选择无重复序列、无高级结构且 GC 含量在 40%-65%之间的区域。常用载体线性化方法有以下 2 种:
1.1 酶切法制备线性化载体
针对较大的载体且有合适的酶切位点时,建议使用酶切法。其中,双酶切比单酶切的效果更好。双酶切方法使载体线性化更完全,降低转化背景(假阳性克隆);若使用单酶切线性化,需要适当延长酶切时间以减少环型质粒残留,降低转化背景。建议酶切后取少量酶切产物进行电泳,以确保全部载体被切开。平末端和粘性末端均可。
Ezmax ® Universal CloneMix 重组反应体系内无 DNA 连接酶,不会引发载体自连。因此,即使是单酶切方式制备的线性化载体也无需进行末端脱磷酸处理。重组产物转化后出现的假阳性克隆(无插入片段),绝大部分是由未线性化环型载体转化形成。如果假阳性克隆比例较高,推荐重新制备线性化载体。
酶切完成后,应快速将内切酶 65°C,20 min 灭活,或对目的产物纯化后用于后续的无缝拼接反应。
1.2 反向 PCR 扩增法制备线性化克隆载体
建议使用高保真 DNA 聚合酶进行载体的扩增以降低扩增突变的引入。本试剂盒与常规PCR的反应体系兼容;因此,如果 PCR 产物条带单一,则可直接用于后续的重组反应。如果PCR 扩增产物有杂带,则应将 PCR 产物进行电泳以及胶回收纯化后再用于无缝拼接,以提高产物纯度并去除一部分未线性化的环型载体,有利于提高重组效率。
线型 DNA 序列作为模板时无需去除原本的模板;而环型质粒作为模板时则需要去除,可利用抽提模板带有甲基化修饰的特点,使用 Dpn I 酶切进行去除。
2. 制备外源 DNA 插入片段
2.1 设计用于扩增外源 DNA 片段的引物
插入片段扩增引物由两部分构成:同源序列+特异性引物,即在插入片段的正/反向引物的5'-端引入同源序列,使扩增产物之间以及扩增产物与线性化克隆载体之间都具有能够相互同源重组的完全一致的序列(15 - 25 bp,不包括酶切位点)。通常在引物的 5'-端引入与线性化克隆载体末端一致的DNA序列,长度一般选择 18 bp,也可在 15-25 bp 之间进行调整。多片段克隆时需保持相邻插入片段末端同源性。
Primer F 插入片段正向扩增引物设计方式:
5'-上游载体末端同源序列+酶切位点(可选)+基因特异性正向扩增引物序列-3'
Primer R 插入片段反向扩增引物设计方式:
5'-下游载体末端同源序列+酶切位点(可选)+基因特异性反向扩增引物序列-3'
基因特异性正/反向扩增引物序列即常规插入片段正/反向扩增引物序列,Tm 值 60 ~ 65℃为佳;
上/下游载体末端同源序列即线性化载体最末端序列(用于同源重组),GC 含量 40% ~ 60%为佳。
计算扩增引物退火温度时,只需计算基因特异性扩增序列的 Tm 值,引入的同源序列及酶切位点不应参与计算。
引物序列合成时推荐选择 PAGE 纯化方式,有利于提高克隆效率。
具体引物设计,可参照以下示例:
示例一:单个插入片段扩增引物设计(以 Hind Ⅲ和 EcoR Ⅰ双酶切线性化载体为例)

示例二:多个插入片段扩增引物设计(以 Hind Ⅲ和 EcoR Ⅰ双酶切线性化载体为例)

2.2 PCR 扩增外源 DNA 片段
建议使用高保真 DNA 聚合酶进行外源 DNA 片段的扩增;无需考虑产物末端是否有A加尾,不影响最终的拼接准确性和拼接效率。与载体制备的流程类似,如果外源 DNA 的 PCR 扩增条带单一,则可以不用纯化,直接用于后续的拼接反应。但 PCR 扩增产物纯度较低时,建议进行胶回收纯化,有利于提高重组效率。
如果用于制备外源 DNA 的模板为环型质粒,且抗性和后续待拼接载体的抗性相同,则残留的外源质粒模板会导致大量的转化背景,影响目标克隆的挑选,因而需要去除质粒模板;可通过电泳法胶回收目的片段或者通过Dpn I 酶切法去除带有甲基化修饰的环型质粒。
3. 重组反应
冰上配置反应体系,37℃反应 5-30 min(1~2 个插入片段设置 5-15 min;3~5 个插入片段设置15-30min)。反应结束后,将反应产物置于冰上 5 min 以终止反应。反应产物可直接用于转化实验或冻存于-20℃备用。
| 组分 | 体积 |
| 2×Ezmax® Universal CloneMix | 10μL |
| 线性化载体 | 20ng/kb(最低40ng) |
| 外源DNA插入片段 | 40ng/kb(最低20ng/每片段) |
| ddH2O | Upto20μL |
建议设置阴性对照,即上述体系不加 2 × Ezmax ® Universal CloneMix;若负对照长出很多克隆,则说明在载体制备或外源插入片段制备过程中存在载体未线性化完全、外源片段扩增模板质粒未去除彻底等问题,需要重新制备或纯化。
推荐载体和外源插入片段的最佳摩尔比是 n(载体):n(插入片段)=1:2;推荐直接用片段长度来计算用量,无需算摩尔浓度,以 4 kb 长度的载体为例,使用量为 20 ng/kb×4 kb=80 ng,低于 2 kb 的载体取最低使用量40ng;以 1 kb 长度的插入片段为例,使用量为 40 ng/kb×1 kb=40 ng,低于 0.5 kb 的外源插入片段取最低使用量20ng。
建议使用 PCR 仪等温控较精准的仪器反应,反应温度或反应时长相差太大都会影响克隆的效率。
4. 重组产物转化
1)冰上解冻克隆用感受态细胞(如:DH5α Competent cell)等。
2)取上述反应液 10 μL 加入 100 μL 感受态细胞中,轻轻混匀,冰上静置 30 min。
3)42℃水浴热激 90 sec 后,立即置于冰上冷却 2-5 min。
4)加入 900 μL SOC 或 LB 液体培养基 (不添加抗生素),37℃摇菌复壮 45 min。
5)将复壮后的菌液用 5000 rpm 离心 5 min,弃掉 800 μL 上清,并用剩余培养液将菌体重悬,用无菌涂布棒将菌液涂布在含有正确抗性的平板上,于 37℃培养箱中倒置培养 12-16 h。
6)平板上长出的克隆可以使用“菌落 PCR 的方法”进行快速鉴定(或者“质粒快速抽提的方法”)。针对阳性克隆,可根据实验需求进行进一步的序列测定。
重组产物转化体积最多不应超过所用感受态细胞体积的 1/10。
5. 阳性克隆鉴定
1)菌落/菌液 PCR 鉴定:用枪头挑取单菌落至 10 μL 无菌水中混匀后取 1 μL 为模板,或直接蘸取菌落至PCR 体系中扩增(建议至少使用一条通用引物,避免假阳性结果);
2)以质粒为模板 PCR 鉴定:挑取单克隆至含相应抗生素的 LB 培养基中,37℃,220 rpm过夜摇菌后抽提质粒作为模板,可使用载体通用引物或特异性引物扩增;
3)酶切鉴定(若有需要):挑取单克隆至含相应抗生素的 LB 培养基中,37℃,220 rpm过夜摇菌后抽提质粒,使用相应内切酶酶切质粒后电泳检测片段大小;
4)测序:建议使用载体通用引物测序鉴定。
注意事项
1. 酶切制备线性化载体时,大部分情况无需回收载体,但对于较大的外源模板,回收载体可提高克隆效率和阳性率。
2. 部分限制性内切酶产生粘性末端,其线性化的载体直接转化大肠杆菌可以在菌体内部获得修复,长出假阳性克隆,针对这种情况,建议更换酶、或双酶切、或加大验证的克隆数量。
3. 反向 PCR 扩增制备线性化载体时,环型质粒作为模板,PCR 产物需用 Dpn I 处理,以减少环型质粒模板残留对克隆阳性率的影响。
4. 反向 PCR 扩增制备线性化载体或外源片段时,若 PCR 产物单一,则可直接用于后续的重组反应,若PCR 产物不单一,则应将 PCR 产物进行核酸电泳用胶回收进行纯化。
5. 由于重组反应体系中含有盐离子,反应产物不可以直接电击转化。若需要电击转化,则需要对反应产物进行脱盐处理。由于用于反应的 DNA 很少,不推荐使用乙醇沉淀或者胶回收纯化,可使用适合微量DNA 透析的滤膜进行脱盐处理。
6. 直接使用酶切产物或 PCR 扩增产物进行重组反应时,建议添加的体积不超过总体积的1/5。如外源DNA片段由 PCR 扩增获得,且不回收纯化直接用于重组反应,同样建议反应体积不超过总体积的1/5。若外源 DNA 片段和线性载体均不纯化,其体积之和应低于总体积 1/5。
7. 重组反应时,为了达到更高克隆效率和阳性率推荐线性载体和外源片段的摩尔比为1 : 2。
Note
For research use only. Not suitable for clinical or therapeutic use.

 地 址:
地 址: 产品销售:
产品销售: E - mail :
E - mail : 邮 编:
邮 编:
 Amily
Amily


